L’évaluation médico-économique des DM : état des lieux et enjeux
Il y a un peu moins de 7 ans, on assistait à la publication d'un décret rendant obligatoire l'évaluation médico-économique des produits de santé. Où en est-on aujourd'hui dans le secteur du dispositif médical ? Sandrine Bourguignon nous rappelle ici les spécificités à prendre en compte et dresse le bilan.
Par Sandrine Bourguignon, membre du groupe AFCROs-DM
L’évaluation médico-économique des dispositifs médicaux existe règlementairement depuis le décret 2012 de la HAS (Décret n° 2012-1116 du 2 octobre 2012 relatif aux missions médico-économiques de la Haute Autorité de santé ) qui a mis en place l’évaluation de l’efficience pour les produits de santé. Les dispositifs médicaux éligibles doivent revendiquer une Amélioration de Service Attendu (ASA) de I à III et avoir un impact significatif, qu’il s’agisse d’un impact économique avec un chiffre d’affaires attendu à 2 ans - toutes indications confondues - de plus de 20 millions d’euros TTC, et/ou d’un impact organisationnel dans la prise en charge de patients, les recommandations de pratiques professionnelles ou le cas échéant, le prix du produit.
Cette évolution est apparue sous la contrainte budgétaire récurrente imposant de faire des choix quant à l’allocation des ressources en santé. L’efficience devient un critère supplémentaire dans l’évaluation des produits de santé. Elle est mesurée par la CEESP (Commission d’Evaluation Economique et de Santé Publique) qui émet un avis sur la méthodologie utilisée pour l’analyse médico-économique et qualifie le résultat d’efficience le cas échéant. Le Comité Economique des Produits de Santé (CEPS) a ensuite la possibilité de tenir compte ou non de cet avis dans le cadre de sa négociation de prix.
En outre, l’évaluation médico-économique est désormais utilisée de manière plus large dans l’évaluation des prises en charge et des impacts organisationnels. Toutefois, les méthodes auxquelles on a recours dans ce contexte sont souvent confondues avec d’autres types d’analyses économiques comme les analyses d’impact budgétaires (AIB) ou les approches de retours sur investissements (ROI) en établissements de santé.
Ce champ d’étude est d’autant plus intéressant que les dispositifs médicaux, plus encore que les médicaments, ont souvent une incidence directe sur les pratiques et les parcours de soins car ils modifient les gestes techniques.
Rappel des particularités de l'évaluation médico-économique
L’évaluation médico-économique est une des méthodes d’analyse économique qui considère à la fois les résultats cliniques et économiques d’une prise en charge. Cette approche est nécessairement comparative et conduit à discuter un ratio coût-efficacité ou coût-utilité, selon le critère de jugement retenu. Les guides méthodologiques, dont celui utilisé par la HAS (Choix méthodologiques pour l’évaluation économique à la HAS – octobre 2011), recommandent une évaluation de type coût / QALY (Quality Adjusted Life Year c’est-à-dire une année de vie en parfaite santé). L’analyse de l’efficience revient à évaluer le ratio entre un gain d’efficacité clinique et le coût total de la prise en charge pour atteindre ce gain. Les études sont réalisées selon une perspective d’analyse : assurance maladie, établissements de santé, patients etc.
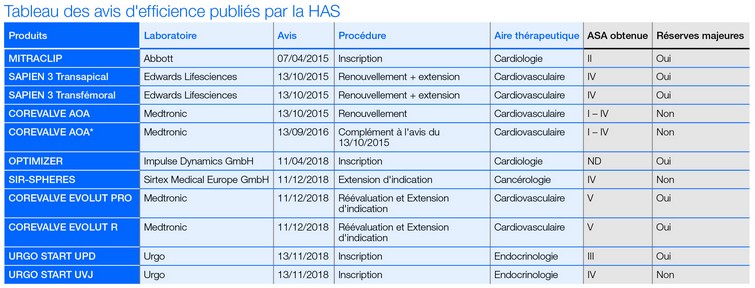
En France, les avis d’efficience publiés par la HAS discutent d’un Ratio Différentiel Coût-Résultat (RDCR), l’équivalent du ratio ICER (Incremental Cost-Effectivness Ratio) dans les publications internationales. A ce jour, la HAS a publié dix avis d'efficience (voir tableau ci-dessus). On note que la majorité des produits ont finalement obtenu une ASA IV ou V et des réserves majeures, de nature méthodologique.
En quoi le dispositif médical se distingue-t-il du médicament ?
Il convient de retenir 3 spécificités majeures pour les DM par rapport aux médicaments :
- les comparateurs : il s'agit souvent de gestes techniques, opératoires ou de prises en charge médicamenteuses. La sélection et la qualification des comparateurs peut s’avérer complexe puisqu’à considérer de manière large, en dehors d’une logique d’indication stricte.
- les données cliniques : elles peuvent s’avérer moins robustes selon le type de DM étudié que pour le médicament. L’amélioration très nette des études cliniques dans le champ des DM et la nouvelle directive européenne devraient rapidement combler ces écarts.
- les évolutions de gamme : elles constituent un motif de nombreuses réserves majeures posées par la CEESP. Cette dernière considère en effet qu’une étude clinique comparative devrait être conduite pour chaque évolution de gamme. Cette question est cruciale pour les industriels et la position de la CNEDiMTS diffère sur ce point de celle de la CEESP, ce qui pose une question de cohérence entre les différentes évaluations conduites par la HAS.
Le point de vigilance est donc de bien qualifier le type d’étude à réaliser. Pour les DM, les évaluations faites par la HAS sont peu nombreuses, mais les analyses d’impact budgétaire ou les modèles de ROI, réalisés en perspective hospitalière, ont aussi un réel intérêt dans une prise de décision d’utilisation ou non d’un dispositif par des professionnels.
Les aspects méthodologiques, spécifiques au secteur du DM, doivent être pris en compte dans la manière de structurer les analyses et la question de l’adaptation, par la CEESP, des critères d’évaluation au DM doit être posée. Point d’autant plus important que la négociation des futurs accords-cadres avec le CEPS devrait renforcer le poids de ces évaluations dans la détermination des prix. Rappelons ici que l’ancienne directrice du service d’évaluation CEESP vient de prendre la tête du département dispositif médical du CEPS.






 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn