Risques liés aux phtalates dans les dispositifs médicaux : où en est-on ?
La présence dans les dispositifs médicaux de certains phtalates dangereux pour la santé humaine doit faire l’objet d’une attention particulière de la part des fabricants. NAMSA nous précise ici le contexte et les aspects de la réglementation européenne à prendre en compte.
Par Marie-Charlotte Notargiacomo, Senior Biological Safety Scientist chez NAMSA
Les phtalates sont utilisés comme agents plastifiants dans la fabrication de certains plastiques, notamment pour leur conférer souplesse et flexibilité. C'est le cas du chlorure de polyvinyle (PVC), qui est utilisé dans les dispositifs médicaux tels que les sets de perfusion, les circuits de circulation extracorporelle, les lignes de dialyse, les circuits respiratoires, les tubulures d’alimentation, les sondes (d’aspiration, vésicales, endotrachéales, etc.), les poches de sang et les gants médicaux.[1],[2]
Les phtalates sont obtenus par estérification d’un acide phtalique avec un ou plusieurs alcools. En fonction de la longueur de leur chaîne latérale, ils sont classés comme étant à faible ou haut poids moléculaire.
Les phtalates de bas poids moléculaire les plus utilisés sont les suivants :[2]
- Diisobutyl phthalate (DIBP)
- Dibutyl phthalate (DBP)
- Benzyl butyl phthalate (BBP)
- Di(2-ethylhexyl)phthalate (DEHP)
Quant aux phtalates de haut poids moléculaire, les plus courants sont les :[2]
- Diisodecyl phthalate (DIDP)
- Diisononyl phthalate (DINP)
- Di(2-propylheptyl) phthalate (DPHP)
- Ditridecyl phthalate (DTP)
Ces phtalates représentent 80 % de la consommation de phtalates en Europe.
Le DEHP a été pendant de nombreuses années le plastifiant ester phtalate le plus fréquemment employé dans les dispositifs médicaux. Notons qu'il présente un effet stabilisant sur les globules rouges des poches de sang, réduisant l’hémolyse pendant le stockage et améliorant l’efficacité transfusionnelle.
Deux problématiques liées aux phtalates : la toxicité et l'exposition
La toxicité du DEHP pour la santé humaine est largement documentée. Le DEHP a été classé comme étant reprotoxique de catégorie 1B (i.e., Mention de danger H360FD : peut nuire à la fertilité - susceptible de nuire au fœtus) selon le Règlement Européen No. 1272/2008 (Règlement dit « CLP »). Plusieurs autres phtalates, par exemple le BBP, DBP, DIBP, mais également d’autres, ont cette même classification (reprotoxique 1B). De plus, ayant une structure chimique similaire à celle des hormones stéroïdes naturellement présentes dans le corps humain, certains phtalates sont suspectés d’agir comme des perturbateurs endocriniens.[2]
Pour conférer une structure souple au PVC, il n’existe pas de liaison covalente entre le plastifiant et la matrice. Le phtalate peut donc migrer facilement hors de la structure PVC vers les solutions ou substances en contact avec le PVC. Le DEHP est le plastifiant ayant le plus grand pouvoir de migration, tandis qu'une migration plus faible a été mesurée pour le DINCH (8 fois plus petit), le DEHT (18 fois) et le TOTM (plus de 100 fois plus petit que le DEHP). La migration de chaque plastifiant va varier en fonction de la nature des fluides en contact (migration favorisée en cas de contact avec des substances lipophiles), de la composition du PVC (présence d’autres additifs) et du contexte environnemental (durée de contact, température, débit).[1],[2]
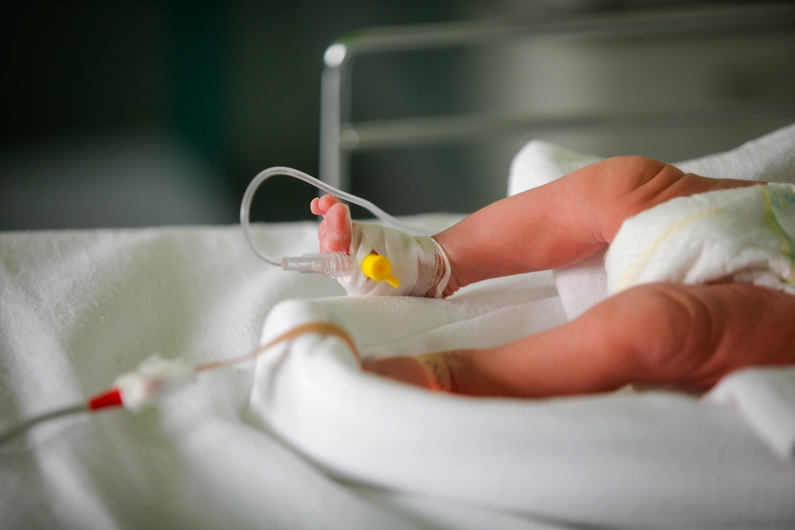
Pour la population générale, la nourriture, via les conditionnements plastiques, est la principale source d'exposition aux plastifiants. Dans le domaine médical, les patients peuvent être exposés aux phtalates par ingestion, inhalation, absorption cutanée et autres voies parentérales. Les nourrissons nés prématurément dans les unités de soins intensifs ainsi que les patients subissant des hémodialyses et/ou une oxygénation extracorporelle par membrane, ont été identifiés comme des groupes de patients à haut risque d’exposition aux phtalates.[1],[2]
Des restrictions règlementaires
Parmi les patients concernés...
... un risque d'exposition important chez les prématurés
Lorsque les phtalates pénètrent dans le corps humain, leur demi-vie varie de quelques heures à plusieurs jours avant leur excrétion dans l'urine, la sueur ou les selles. Le métabolisme des phtalates comprend généralement deux étapes : l'hydrolyse et l'oxydation qui entraineront la formation de monoesters hydrolytiques, et une étape de conjugaison qui a pour but de produire des conjugués glucuronides hydrophiles, plus facilement éliminables. Les adultes excrètent des phtalates conjugués à l'acide glucuronique via l'urine, mais la voie de conjugaison chez les nourrissons est immature, en particulier chez les prématurés, et leur taux de filtration glomérulaire est faible.[2] L'exposition des nouveau-nés prématurés dans les unités de soins intensifs est donc particulièrement préoccupante, considérant que ces nouveau-nés sont en contact constant avec des sondes d'alimentation, des sondes endotrachéales et/ou des cathéters ombilicaux. Il a d’ailleurs été observé que les concentrations en phtalates dans les urines étaient significativement plus élevées chez les nouveau-nés en service de néonatologie que chez les nourrissons nés à terme.[2]
Une attention particulière est portée aux substances dites « CMR » (Cancérogène, Mutagène ou toxique pour la Reproduction) et aux perturbateurs endocriniens. Afin de limiter l’utilisation de substances dangereuses dans les dispositifs médicaux, le Règlement Européen 2017/745, amendé par 2023/607, exige que les dispositifs ou les parties de dispositifs ou matériaux utilisés ne contiennent pas de substances CMR de catégorie 1A ou 1B (selon le Règlement (CE) n° 1272/2008), ou de perturbateurs endocriniens à une concentration supérieure à 0,1 % (m/m) (exigence 10.4.1). Le cas échéant, la présence de telles substances à une concentration > 0,1 % (m/m) devra être justifiée par le fabricant (exigence 10.4.2), et des étiquettes signalant la présence de ces substances devront être apposées sur le dispositif et/ou sur le conditionnement (exigence 10.4.3).
Ces exigences ont pour but d’inciter à substituer autant que possible ces substances dites dangereuses pour la santé humaine. L’utilisation de ces dernières devra être justifiée par une analyse approfondie des risques et des avantages de l'exposition du patient/utilisateur, notamment en discutant d’autres matériaux ou des conceptions alternatives. L'impact de ces alternatives sur la fonctionnalité et les performances du dispositif fait également partie de cette évaluation. La guidance publiée par le SHEER en 2019, et mise à jour en juin 2024, présente les différentes étapes à suivre pour l’évaluation du bénéfice-risque liée à la présence de phtalates CMR ou perturbateurs endocriniens dans certains dispositifs médicaux.[1]
Les alternatives les plus utilisées aux phtalates CMR sont les suivantes :[1],[2]
- Tri-n-octyl trimellitate (TOTM)
- Diisononyl hexahydrophthalate (DINCH)
- Di(2-ethylhexyl) terephthalate (DEHT)
- Diisononyl phthalate (DINP)
- Di(2-ethylhexyl) adipate (DEHA)
- Acetyl tributyl citrate (ATBC)
- n-1 butyryl-tri-n-hexyl citrate (BTHC).
Cependant, certaines alternatives peuvent provoquer une toxicité sur la reproduction, par analogie avec le DEHP. Jusqu'à présent, ces substances alternatives nécessitent des doses plus élevées pour induire une toxicité sur la reproduction, ce qui indique un risque potentiel plus faible d'induire de tels résultats.[1] Toutefois, les informations toxicologiques sont moins exhaustives pour les plastifiants alternatifs, ce qui limite l’évaluation des risques liés à ces substituts.
Ce que les fabricants doivent retenir...
L’analyse des matériaux et des procédés de fabrication du dispositif est une première étape cruciale dans l’évaluation des risques résiduels d’un dispositif. Les études d’extractibles et d’analyse chimique qui suivent la norme ISO 10993-18, couplées à une analyse toxicologique des extractibles selon la norme ISO 10993-17, peuvent apporter des éléments pour minimiser la réalisation de tests biologiques impliquant l’utilisation d’animaux et permettre de mesurer quantitativement les risques toxicologiques liés à de telles substances. Lorsque l’exposition à la substance issue du dispositif (dans des conditions maximalisées) est nettement inférieure à la dose journalière tolérable (i.e., marge de sécurité > 1, en utilisant une approche conservatrice), le risque de toxicité systémique liée à cette substance peut être considéré comme négligeable. A l’inverse, lorsque le ratio est inférieur à 1, cela indique généralement un risque toxicologique possible ou probable du chimique en question. L’évaluation toxicologique est toujours adaptée au dispositif et à son utilisation clinique.
NAMSA, CRO préclinique et clinique, propose un large éventail de prestations (consulting et testing) dédiées aux DM et aux DM de diagnostic in vitro destinés à être commercialisés à travers le monde. Son champ de compétences s’étend de la conception à la post-commercialisation, en passant par toutes les étapes du développement et de la production.
Pour les fabricants, il est important d’investiguer la source de phtalates dans le dispositif auprès de leurs fournisseurs de matières premières mais également au sein des étapes de fabrication. Le DEHP étant classé reprotoxique 1B, si la concentration est > 0.1 % (m/m), le fabricant devra justifier la présence de cette substance CMR, conformément au GSPR 10.4.2. Le cas échéant, le DEHP devra être substitué.
Si le règlement européen sur les dispositifs médicaux autorise l'utilisation de phtalates aux propriétés potentiellement CMR 1A/1B ou perturbant le système endocrinien dans des dispositifs médicaux à des concentrations supérieures à 0,1 % (m/m), cette exception est limitée aux cas dans lesquels cela peut être justifié par une analyse approfondie des risques et des avantages, notamment en explorant d’autres alternatives. Bien qu’il convienne de réduire au maximum l’exposition aux phtalates, il est important de garder à l’esprit que beaucoup d’interventions entraînant une exposition aux phtalates permettent aussi de sauver des vies, et restent à ce titre nécessaires en l’absence et dans l’attente d’alternatives moins préoccupantes pour leurs effets délétères sur la santé humaine.
[1] Scientific Committee on Health, Environmental and Emerging Risks (SCHEER). Update of the Guidelines on the benefit-risk assessment of the presence of phthalates in certain medical devices covering phthalates which are carcinogenic, mutagenic, toxic to reproduction (CMR) or have endocrine-disrupting (ED) properties. Adopted on 14 June 2024.
[2] Šimunović, Antonela; Tomić, Siniša; Kranjčec, Krunoslav (2022): Medical devices as a source of phthalate exposure: a review of current knowledge and alternative solutions. In Arhiv za higijenu rada i toksikologiju 73 (3), pp. 179–190. DOI: 10.2478/aiht-2022-73-3639.






 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn




















