Trois fabricants partagent leur expérience de la mise en conformité à l’UDI
Comment les fabricants de DM doivent-il se préparer à l'UDI ? C'est la question à laquelle trois experts des entreprises Oticon, Johnson & Johnson et Convatec ont répondu lors d'une table ronde organisée par Pharma IQ.
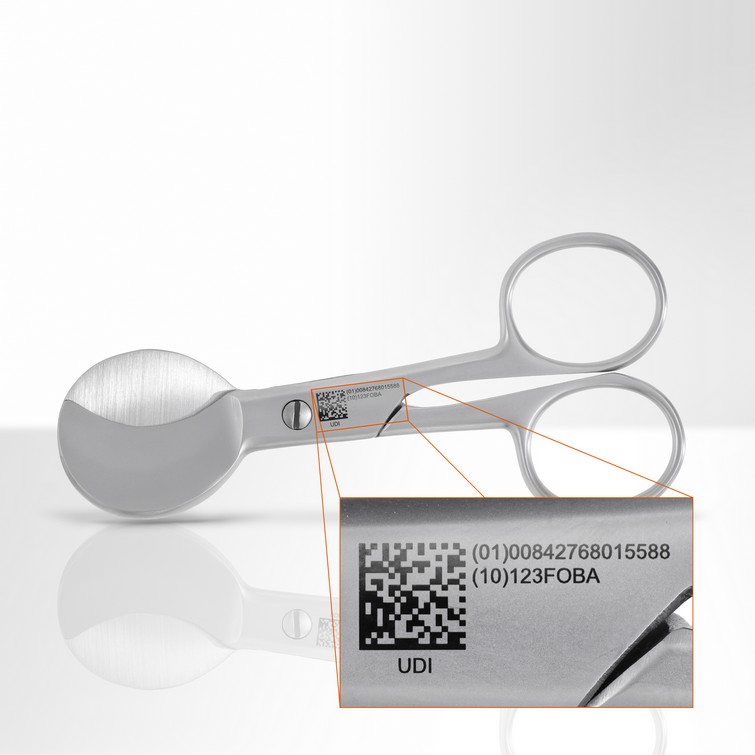
La nouvelle réglementation européenne implique l'Identification Unique des Dispositifs médicaux (UDI). Pour satisfaire à cette obligation, les fabricants sont tenus de s'organiser dès maintenant afin de respecter les délais qui approchent à grands pas. Cependant, les exigences des autorités ne sont pas encore claires, et les entreprises ne peuvent pas s'engager dans des projets coûteux.
La question qui se pose aux fabricants de dispositifs médicaux est la suivante : que pouvons-nous faire aujourd'hui, en toute sécurité, pour nous préparer au mieux à la réglementation à venir ?
Rendez-vous en avril à Bruxelles pour se préparer à l’UDI
En amont de l'European UDI Forum 2019 (24 et 25 avril prochains à Bruxelles), son organisateur IQPC a publié une interview effectuée lors d'une table ronde animée par sa division Pharma IQ. Cette table ronde réunissait trois industriels :
- Tommy Røsholt, gestionnaire de projet de mise en conformité à l'UDI chez Oticon,
- Tom Jones, directeur du programme UDI pour Johnson & Johnson Supply Chain
- Jenny Young, gestionnaire de projet MDR chez Convatec.
Téléchargeable à partir de cette page, l'interview permet de découvrir les priorités de ces experts en matière d'UDI, la manière dont ils ont géré cette situation difficile et les conseils qu’ils donneraient aux autres fabricants de DM.





 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn




















