Microplastiques : une modification du règlement REACH qui impacte les DM
Le Règlement (UE) 2023/2055 modifie l’annexe XVII du règlement (CE) No.1907/2006, plus connu sous le nom de REACH, quant aux microparticules de polymère synthétique. Cette nouvelle réglementation a un impact majeur pour de nombreuses industries dont celle du dispositif médical.
Par Paul Fernandes, Toxicologue chez Cehtra et Maud Hamonnou, Référent technique DM et DMDIV chez Cap Compliance
Sont généralement considérées comme microparticules de polymère synthétique, les particules de polymères dont la taille est inférieure à 5 mm. Elles peuvent être composées de mélanges de polymères, d'additifs et d'impuretés résiduelles.
Omniprésents dans l'environnement, ces microplastiques peuvent provenir de l’usure de morceaux plus gros, comme les pneus ou les textiles synthétiques, ou être fabriqués et ajoutés à des produits dans un but spécifique, comme servir de billes exfoliantes dans des gommages en cosmétique par exemple. Dans tous les cas, ils peuvent avoir des effets néfastes sur la santé humaine et l’environnement, sachant qu'ils persistent dans les milieux, s'accumulant dans les organismes via la nourriture et l'eau.
Selon l’Agence européenne des produits chimiques (ECHA), 42 000 tonnes de microplastiques sont, chaque année, libérées des produits auxquels ils ont été ajoutés intentionnellement. La principale source de cette pollution est le matériau de remplissage granulaire des terrains de sport artificiels.
L'Europe s'est emparée du problème en 2017, pour aboutir en septembre 2023, à l'adoption du règlement 2023/2055, destiné à limiter la pollution par les microplastiques sur le territoire européen.
Une interdiction avec des exemptions dont les DMDIV
Pour être plus précis, le règlement 2023/2055 vise à interdire la commercialisation de microplastiques, seuls ou mélangés au sein de produits de consommation courante, si leur concentration y est supérieure ou égale à 0,01 % en poids.
Il existe des exemptions, sous conditions dans certains cas, qui concernent les microplastiques utilisés sur des sites industriels, dans les médicaments, les fertilisants, les additifs alimentaires, les aliments pour animaux et... les dispositifs de diagnostic in vitro (DMDIV).
Sont aussi exemptés les microplastiques intégrés de façon permanente dans une matrice solide, évitant ainsi les rejets dans l’environnement.
Tout autre produit contenant des microplastiques ne pourra plus être mis sur le marché, et cela inclut les DM au sens du Règlement (UE) 2017/745.
Impacts sur les dispositifs médicaux
Les fabricants de DM contenant des microplastiques n'échappent donc pas à l'obligation de se conformer à cette nouvelle réglementation. Certains d'entre eux vont devoir revoir leurs procédés de fabrication et leurs produits pour échapper à l’interdiction de mise sur le marché.
Des dispositifs médicaux qui contiennent des microplastiques pourraient effectivement devoir être reformulés ou retirés du marché. Cela impacterait leur disponibilité et nécessiterait des investissements significatifs pour développer des alternatives sans microplastiques.

Figure 1 - Les modifications de la réglementation REACH vont impacter la documentation technique des DM contenant des microplastiques, et notamment les parties en bleu (crédit photo : Cap Compliance).
Les fabricants concernés vont devoir gérer des modifications qui auront des répercussions sur la documentation technique (DT), et notamment sur les parties surlignées en bleu dans la Figure 1 ci-contre.
Enfin, les impacts de cette reformulation devront être suivis dans le cadre de la Surveillance Après commercialisation (SAC), et s'il y a lieu, du Suivi Clinique Après Commercialisation (SCAC). Les plans de SAC et de SCAC devront donc être mis à jour.
Face à ces impacts considérables, 6 ans ont été jugés nécessaires pour la reformulation et la transition vers des solutions de remplacement appropriées. Autrement dit, les DM contenant des microplastiques seront soumis à une interdiction de commercialisation à partir du 17 octobre 2029.
Impacts sur les DMDIV
Comme indiqué plus haut, l’interdiction de mise sur le marché ne s’applique pas aux DMDIV. Cependant, à partir du 17 octobre 2026, les fournisseurs de ces dispositifs contenant des microparticules de polymère synthétique devront fournir des instructions d’utilisation et d’élimination expliquant aux utilisateurs professionnels et au grand public comment éviter les rejets de microparticules dans l’environnement.
Ces informations devront être fournies sous forme de texte visible, lisible et indélébile ou sous forme de pictogrammes. Elles devront être apposées sur l’étiquette, l’emballage ou la notice du dispositif et rédigées dans les langues des Etats dans lesquels il est commercialisé.
Cela implique donc une mise à jour de la documentation technique des DMDIV concernés, notamment de la partie 2 ("Informations devant être fournies par le fabricant").
En complément, les fabricants concernés, mettant leur dispositif sur le marché pour la première fois, devront communiquer à l’ECHA, au plus tard le 31 mai de chaque année, la description des utilisations, les quantités de microparticules libérées dans l’environnement, et la référence à la dérogation applicable. Cela devra donc être prévu dans les process des fabricants.
Fournisseurs et chaîne d’approvisionnement
Il est aussi important de noter que si les fabricants de DM sont directement impactés par l’interdiction de commercialisation, les fournisseurs de microparticules seront eux aussi soumis à des obligations d’information.
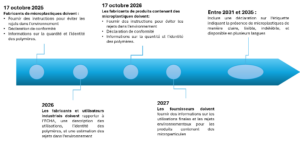
Figure 2 : Résumé des différentes étapes et échéances que les fournisseurs de microparticules devront suivre dans les années à venir (crédit photo : Cap Compliance).
La frise temporelle de la Figure 2 ci-contre résume les différentes étapes et échéances que les fournisseurs de microparticules devront suivre dans les années à venir.
L’ECHA a prévu de publier, d’ici la fin de l’année, un guide destiné à accompagner tous les acteurs concernés pour effectuer ces déclarations.
En conclusion, si le Règlement 2023/2055 représente un défi majeur pour les fabricants concernés, il offre également une opportunité pour l’industrie du DM de développer des alternatives plus durables et respectueuses de l’environnement.








 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn




















