Dossiers > Réglementation
Equipements de production > Stérilisation
EN ISO 13004:2023 : quels impacts pour la stérilisation par irradiation ?
La nouvelle version de la norme ISO 13004 pourrait bien constituer une mini-révolution en matière de justification de la dose stérilisante pour la validation d'un procédé de stérilisation par irradiation. La société de conseil en Qualité et Affaires Réglementaires Kapsikum nous explique pourquoi.
Par Laetitia Albert, Consultante Dispositifs Médicaux chez Kapsikum
Pour rappel, dans l’univers de la stérilisation par irradiation, la norme EN ISO 11137-1:2015 (harmonisée selon le Règlement (UE) 2017/745) exige d’établir la dose stérilisante pour le produit dans le respect de son paragraphe 8.2.2. Il convient de choisir entre les deux approches suivantes :
- Détermination par la charge biologique (biocharge) si l’on a connaissance du nombre et/ou de la résistance aux radiations des microorganismes présents,
- Choix d’une dose stérilisante de 25 kGy ou de 15 kGy si les conditions sont remplies.
Pour ces deux approches, les notes indiquent que les méthodes d’établissement de la dose stérilisante sont détaillées dans l’ISO 11137-2:2006.
Cependant, il existait une Spécification Technique, la très peu connue ISO/TS 13004 datant de 2013 qui élargissait les possibilités en définissant des doses stérilisantes de 17,5 kGy, 20 kGy, 22,5 kGy, 27,5 kGy, 30 kGy, 32,5 kGy et 35 kGy. La nouvelle version de ce document permet de relancer sa visibilité.
Un choix plus affiné de la dose stérilisante
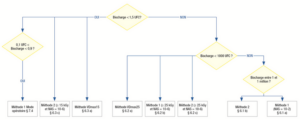
Le choix de la dose stérilisante dépend de la charge microbienne initiale du produit, si connue, comme le montre la Figure 1 ci-dessus.
La charge microbienne se détermine en nombre d’UFC (Unités Formant Colonie : Nombre de colonies dans un échantillon). La norme fixe 3 paliers respectivement de < 0.9 UFC, < 1.5 UFC, <1000 UFC débouchant sur 5 méthodes proposées pour déterminer la dose stérilisante.
L’introduction de la norme EN ISO 13004:2023 ajoute 7 méthodes basées sur la méthode VDmaxDS, identique aux méthodes VDmax25 et VDmax15, en introduisant des paliers intermédiaires (Figure 2 ci-dessous).
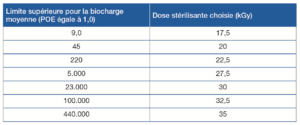
Figure 2 : Extrait ISO 13004 « Tableau 3 — Limite supérieure de la biocharge moyenne correspondant au choix d’une dose stérilisante donnée »
L’utilisation de cette norme fait apparaître trois avantages :
- un coût moindre sur le nombre d’échantillons pour la validation et les audits de dose : si les méthodes VDmax25 et VDmax15 ne peuvent être appliquées, la méthode 1 nécessite 110 produits en validation et en audit de dose alors que les méthodes VDmaxDS ne nécessitent que 40 et 20 produits respectivement ;
- une dose stérilisante plus adaptée selon la charge microbiologique initiale ;
- une prise en compte des produits en vrac (poudres, liquides…).
Un statut qui évolue
La modification la plus importante concerne le changement de statut de l’ISO/TS 13004:2013 « Spécification Technique » qui est devenue la « Norme internationale » ISO 13004:2022, elle-même transposée en norme européenne en juin 2023.
La norme EN ISO 11137-2:2015 étant encore harmonisée selon la Directive 93/42/CEE, pouvons-nous nous attendre à une harmonisation des deux normes européennes selon le Règlement (UE) 2017/745 prochainement ? Ce sera certainement le cas en 2025 car le projet en cours d’approbation ISO/FDIS 11137-1 et donc la version française NF EN ISO 11137-1 prévue pour publication en octobre 2024, prévoit enfin ce lien avec la norme ISO 13004:2022. Affaire à suivre !
Des nouveautés à prendre en compte
Certifié QUALIOPI, Kapsikum propose des formations aux environnements réglementaire et normatif des dispositifs médicaux.
La stérilisation par irradiation fait partie de son catalogue.
Deux nouveautés majeures sont à considérer : l’introduction des produits en vrac et la validation du temps de stockage avant stérilisation.
La nouvelle exigence 5.2.3 selon laquelle « Pour les matériaux en vrac (c’est-à-dire poudres, gels et liquides), un échantillon représentatif peut être considéré comme une POE de 1,0 pour le produit. » révolutionne la stratégie de définition de la POE (« Partie de l’objet échantillonné », ex SIP « Portion de produit échantillonné »).
En effet pour un flacon de 50 g de poudre, si la POE prise est de 1 g, celle-ci devient POE=1 et toute la validation se simplifie par comparaison à la norme ISO 11137-2, où le SIP reste <1, avec pour conséquence le calcul de la charge biologique moyenne multiplié par 50.
Le point 5.3.3 : « Pour un produit capable de soutenir la croissance microbienne, le laps de temps maximal admissible entre la fabrication et la stérilisation du produit doit être déterminé. » devient désormais une exigence. Cela entraîne une détermination préalable de la durée de stockage avant stérilisation à partir de « la fin de fabrication » (est-ce fin de l’assemblage, du mélange, du conditionnement primaire ?). Cette durée devra être respectée pour les productions en routine.
Ces nouveautés se révèlent être des atouts pour revoir la justification de la dose stérilisante dans son ensemble et éviter de « surirradier » vos dispositifs médicaux, surtout pour les dispositifs en vrac (poudre, liquide, gel), ce qui peut se traduire par des économies conséquentes !






 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn




















