Alerte aux fabricants de produits combinés : il est grand temps de vous mettre en conformité !
Les exigences des nouveaux règlements européens relatifs aux dispositifs médicaux (RDM et RDIV) n’épargnent pas les sociétés pharmaceutiques produisant des DM combinés ou des diagnostics compagnons. Cet article du cabinet de conseil Maetrics vise à alerter ces fabricants sur les défis qu'ils doivent relever au plus vite.
Par Elizma Parry, Directrice de la Pratique clinique internationale chez Maetrics
Les produits combinés et les diagnostics compagnons se caractérisent par l'intégration d'un élément de dispositif médical qui peut être soit principal, soit auxiliaire à la partie médicamenteuse du produit. Certains fabricants de produits pharmaceutiques pourraient supposer être exemptés des exigences de la nouvelle règlementation sur les dispositifs médicaux si leurs produits sont principalement médicamenteux. Ils auraient tort, car désormais, les sociétés pharmaceutiques seront soumises à une surveillance identique pour le dispositif et les composants médicamenteux de leurs produits combinés. Avec les règlements européens sur les dispositifs médicaux (RDM, EU 2017/745) et sur les dispositifs médicaux in vitro (RDIV, EU 2017/746), aucun dispositif médical ne peut en effet échapper à un examen réglementaire, quelle que soit sa taille ou sa fonction. Il est concevable que les fabricants de produits combinés ou de diagnostics compagnons, qui étaient jusqu'à présent exemptés d'exigences strictes en matière de DM, n’aient pas conscience de leur obligation de mise en conformité.
Pour ces sociétés, il devient urgent de comprendre les nouvelles exigences afin de commencer au plus tôt la mise en œuvre du processus de mise en conformité. Par-delà le problème des délais imminents d'application obligatoire des deux règlements (respectivement en mai 2020 et en mai 2022), les produits contenant des dispositifs non-conformes risquent d'être retirés du marché. Face à ces conséquences graves, il est vivement conseillé aux laboratoires pharmaceutiques de prendre au sérieux le problème de la conformité et de se préparer rapidement.
Le RDM et les produits combinés
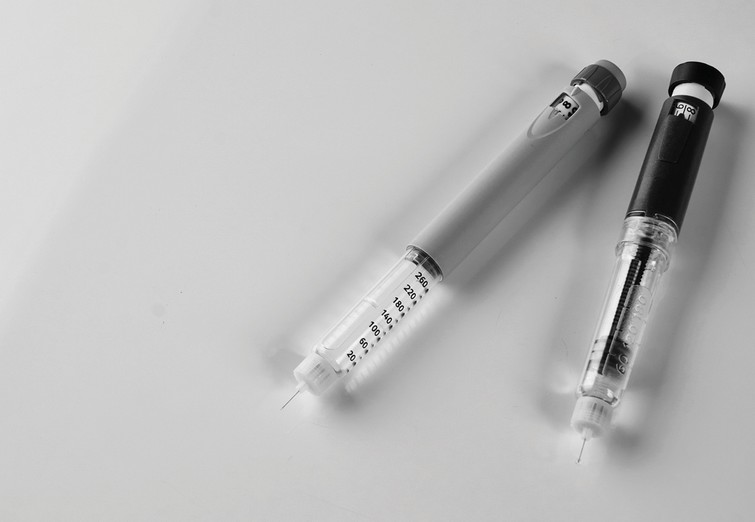
Les produits combinés peuvent être composés de toute combinaison de dispositif, médicament ou produit biologiquement actif. C'est le cas notamment des stylos injecteurs d’insuline et des inhalateurs-doseurs, pour lesquels le dispositif sert de système d'administration du médicament. Ce type de produit, où le DM a une fonction auxiliaire, est actuellement réglementé sous la directive européenne 2001/83 /CE relative aux médicaments, mais il relèvera désormais également du champ d’application du RDM selon l'article 117. L'inclusion des produits combinés dans le RDM découle de leur complexité croissante et de la nécessité de réglementer les composants de dispositifs auxiliaires avec la même minutie que les dispositifs médicaux "autonomes".
 En l'absence des données nécessaires pour soumettre un rapport d'évaluation clinique, certains laboratoires pharmaceutiques pourraient avoir besoin d’effectuer de nouveaux essais cliniques. Des essais coûteux et longs. Il est donc primordial que ces sociétés s'attèlent à recueillir les données manquantes. Investir immédiatement dans ce processus ne peut être que bénéfique, en permettant une transition en douceur et en temps voulu, tout en facilitant la tâche de mise à jour des données cliniques et en assurant leur accessibilité future. Les produits portant le marquage CE au titre de la directive relative aux dispositifs médicaux (93/42/CEE) peuvent bénéficier d’une période de grâce de 2 ans pour l'achèvement de cette transition, mais uniquement si aucune modification ne leur a été apportée entre temps.
En l'absence des données nécessaires pour soumettre un rapport d'évaluation clinique, certains laboratoires pharmaceutiques pourraient avoir besoin d’effectuer de nouveaux essais cliniques. Des essais coûteux et longs. Il est donc primordial que ces sociétés s'attèlent à recueillir les données manquantes. Investir immédiatement dans ce processus ne peut être que bénéfique, en permettant une transition en douceur et en temps voulu, tout en facilitant la tâche de mise à jour des données cliniques et en assurant leur accessibilité future. Les produits portant le marquage CE au titre de la directive relative aux dispositifs médicaux (93/42/CEE) peuvent bénéficier d’une période de grâce de 2 ans pour l'achèvement de cette transition, mais uniquement si aucune modification ne leur a été apportée entre temps.
Dans le même ordre d'idées, les fabricants de produits pharmaceutiques qui contacteront un organisme notifié le feront vraisemblablement pour la première fois. Ils risquent donc de ne pas être au courant de la pénurie actuelle d'organismes de ce type en Europe. À l'heure actuelle, seuls neuf organismes notifiés sont disponibles pour examiner la documentation technique dans le cadre du RDM. Il est fort probable que les organismes notifiés se retrouvent débordés, entraînant sans doute certains retards. Une raison de plus pour soumettre la documentation le plus tôt possible.
Le RDIV et les diagnostics compagnons
En ce qui concerne les diagnostics compagnons, ils relèveront désormais du RDIV. Les diagnostics compagnons sont des DM de diagnostic in vitro qui aident à renforcer la sécurité et l'efficacité d'un médicament en déterminant les patients les plus susceptibles de bénéficier du traitement et ceux qui sont les plus sensibles aux effets indésirables. Le RDIV met en place un nouveau système de classification des risques, la classe A correspondant au risque le plus faible et la classe D au risque le plus élevé. Appartenant à la classe C, les diagnostics compagnons seront donc soumis à un contrôle minutieux de la part des organismes notifiés. Le RDIV est encore davantage touché par la pénurie d’organismes notifiés, puisqu'à ce jour, seulement trois d'entre eux ont été (re-)désignés au titre du nouveau règlement. Il est recommandé que les fabricants commencent à approcher ces organismes, voire ceux en attente de désignation, pour leur gamme de produits spécifique afin de s'assurer une bonne place dans la file d’attente.
En conclusion, si les laboratoires pharmaceutiques doivent accorder toute son importance au processus de conformité, il faut aussi qu'ils se préparent à faire éventuellement face aux conséquences négatives de la non-conformité, notamment l’impact défavorable sur leur réputation suite au retrait possible du marché des produits concernés.
[source des illustrations : Maetrics]






 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn




















