AFCROs

Comment mener l’évaluation clinique d’un logiciel dispositif médical ?
Publié le 12 novembre 2024

DeviceMed Novembre/Décembre 2024
Publié le 05 novembre 2024

12ème Rencontre AFCROs & DM, le 7 novembre 2014 à Paris
Publié le 28 octobre 2024

Solliciter une rencontre précoce avec la HAS : un atout pour les fabricants
Publié le 15 octobre 2024

Essais Cliniques Décentralisés : une révolution dans la recherche médicale
Publié le 01 octobre 2024

DeviceMed Septembre/Octobre 2024
Publié le 09 septembre 2024

DeviceMed guide de l’acheteur 2024-2025
Publié le 10 juillet 2024

Quatre industriels du DM témoignent sur la collecte de données cliniques
Publié le 10 juin 2024
DeviceMed Mai/Juin 2024
Publié le 30 avril 2024

RDM : comment gérer les évènements de sécurité dans le cadre d’une IC ?
Publié le 23 avril 2024

Evaluation clinique des DM : retour sur la journée AFCROs & DM 2023
Publié le 18 mars 2024

DeviceMed Mars/Avril 2024
Publié le 12 mars 2024

DeviceMed Janvier/Février 2024
Publié le 05 février 2024
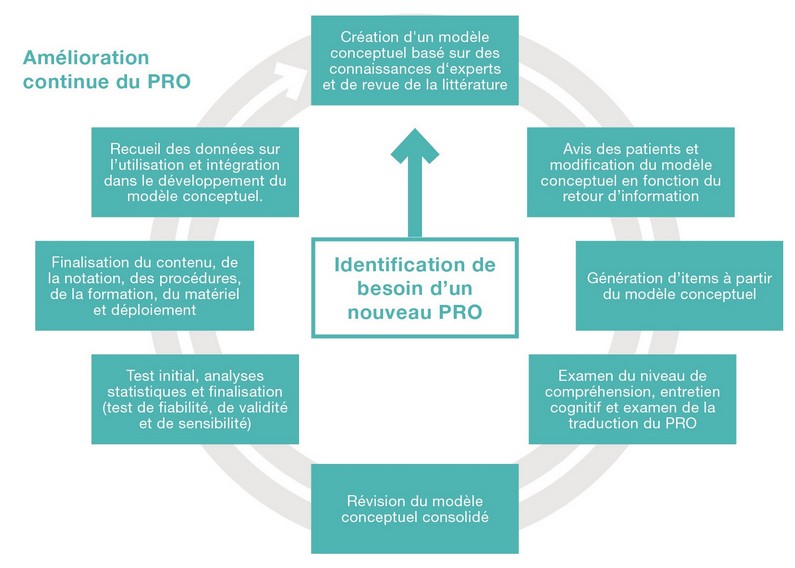
L’expérience patient, partie intégrante des investigations cliniques
Publié le 12 décembre 2023

DeviceMed Novembre/Décembre 2023
Publié le 02 novembre 2023

Utiliser des données externes pour l’évaluation clinique d’un DM
Publié le 31 octobre 2023
Investigation clinique : le secteur de la cardiologie montre l’exemple
Publié le 19 septembre 2023

DeviceMed Septembre/Octobre 2023
Publié le 05 septembre 2023

DeviceMed guide de l’acheteur 2023-2024
Publié le 17 juillet 2023

DeviceMed Mai/Juin 2023
Publié le 01 mai 2023

Choisir une méthodologie statistique pour l’évaluation clinique d’un DM
Publié le 25 avril 2023
DeviceMed Mars/Avril 2023
Publié le 06 mars 2023
DeviceMed Janvier/Février 2023
Publié le 23 janvier 2023

Documenter l’impact organisationnel : les attentes de la CNEDiMTS
Publié le 13 décembre 2022

Les impacts du RDM sur la recherche clinique : deux exemples concrets
Publié le 02 novembre 2022

Comment apporter une preuve clinique suffisante pour se conformer au RDM ?
Publié le 20 septembre 2022
DeviceMed Septembre/Octobre 2022
Publié le 06 septembre 2022

Investigation clinique : quel contrat entre le fabricant et le médecin ?
Publié le 05 juillet 2022
DeviceMed guide de l’acheteur 2022-2023
Publié le 01 juillet 2022

Les fondamentaux de la gestion des risques dans une investigation clinique
Publié le 23 mai 2022
DeviceMed Mai/Juin 2022
Publié le 25 avril 2022
Devicemed Mars/Avril 2022
Publié le 11 mars 2022

10ème Journée de la Recherche Clinique, le 17 mars à Paris
Publié le 11 février 2022
DeviceMed Janvier/Février 2022
Publié le 04 février 2022

De l’intérêt de coupler les données du SNDS à des études de terrain
Publié le 18 janvier 2022
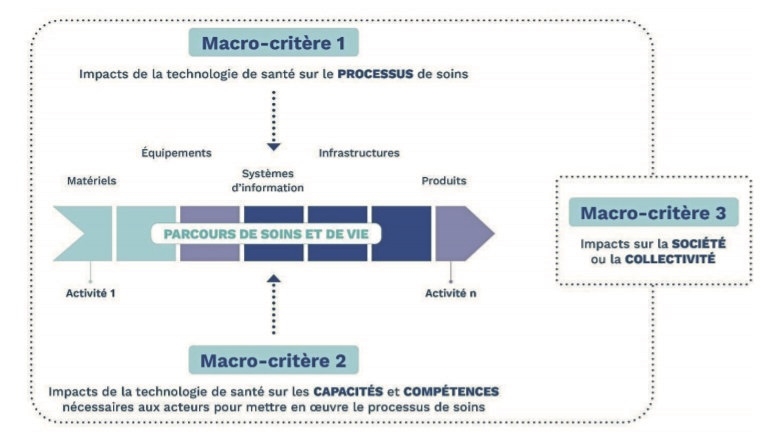
Les enjeux de l’évaluation des impacts organisationnels pour les DM
Publié le 30 novembre 2021
DeviceMed Novembre/Décembre 2021
Publié le 03 novembre 2021

Rendez-vous annuel de l’évaluation clinique le mardi 16 novembre
Publié le 22 octobre 2021

Loi Jardé et Règlement (UE) 2017/745 : le point sur la matériovigilance
Publié le 06 juillet 2021
DeviceMed Mai/Juin 2021
Publié le 06 mai 2021

Recourir au SNDS pour les études observationnelles relatives aux DM
Publié le 07 avril 2021

DeviceMed Mars/Avril 2021
Publié le 22 mars 2021

Norme ISO 14155:2020 : quels changements pour quels impacts ?
Publié le 02 mars 2021

DeviceMed Janvier/Février 2021
Publié le 02 février 2021

DeviceMed Novembre/Décembre 2020
Publié le 10 novembre 2020

DeviceMed Septembre/Octobre 2020
Publié le 02 septembre 2020

Comprendre les enjeux de la recherche clinique : notions de méthodologie
Publié le 21 juillet 2020

DeviceMed Juillet/Août 2020
Publié le 01 juillet 2020

Evaluation clinique et valorisation des DM connectés à l’ère future du RDM
Publié le 12 mai 2020

DeviceMed Mai/Juin 2020
Publié le 04 mai 2020



























