Dossiers > Réglementation
Solution complète pour gérer les études de suivi clinique post-market
Les cabinets ASPE Conseil et Medlinks ont associé leurs compétences dans le domaine des dispositifs médicaux pour proposer une solution adaptée aux exigences du RDM en matière de suivi clinique post-commercialisation. Cette solution combine un logiciel et un accompagnement personnalisé.
Les sociétés ASPE Conseil et Medlinks possèdent une solide expérience dans les domaines de la qualité (ISO 13485:2016, 21 CRF Part 820, MDSAP) et du réglementaire (dossier technique marquage CE, Design History File, Design Master Record) pour les dispositifs médicaux de classe I, Ir, Is, Im, IIa, IIb et III. Elles peuvent toutes deux se prévaloir du dépôt de nombreux dossiers techniques et de leur validation par différents organismes notifiés.
Les deux cabinets de conseil ont décidé de mettre cette expérience en commun et d'en faire profiter leurs clients, notamment pour ce qui concerne les études de suivi clinique post-commercialisation des dispositifs médicaux (PMCF pour Post-Market Clinical Follow-up).
Un règlement astreignant en matière de surveillance post-market
Le règlement européen (UE) 2017/745 relatif aux dispositifs médicaux (RDM ou MDR), a introduit des exigences plus strictes pour les fabricants, en particulier en matière de suivi clinique post-commercialisation. Il s'agit d'un processus continu visant à mettre à jour le rapport d’évaluation clinique (CER), un des dossiers majeurs du dossier technique.
Le suivi clinique post-commercialisation est devenu ainsi une obligation réglementaire pour l’ensemble des dispositifs médicaux à quelques rares exceptions près. Son objectif est de s'assurer que les dispositifs continuent de répondre aux exigences de sécurité et de performance tout au long de leur durée de vie. Il permet également d’apporter des preuves complémentaires de sécurité et de performance, qui n’auraient pas été mises en évidence lors de la rédaction du CER.
Une solution à la carte
C'est dans ce contexte qu'ASPE Conseil et Medlinks ont développé en interne une solution complète et intégrée de PMCF : Klifolo.
Celle-ci se compose des phases suivantes :
- l’analyse du besoin du fabricant ;
- la rédaction du protocole de suivi clinique post marché ;
- l’identification des intervenants de l’étude (professionnels de santé) si le fabricant le souhaite ;
- la collecte des données cliniques au travers d’un outil informatique ;
- le suivi et la vérification des données collectées ;
- l’analyse statistique des données collectées ;
- la rédaction du rapport d’étude de suivi clinique post marché.
Le modèle imaginé par les deux partenaires consiste à proposer une approche personnalisée dans la conception et la réalisation des études PMCF. Ainsi, après l'analyse du besoin du fabricant, tout ou partie de la solution Klifolo peut être mise en œuvre à un coût très compétitif par rapport aux solutions existant sur le marché.
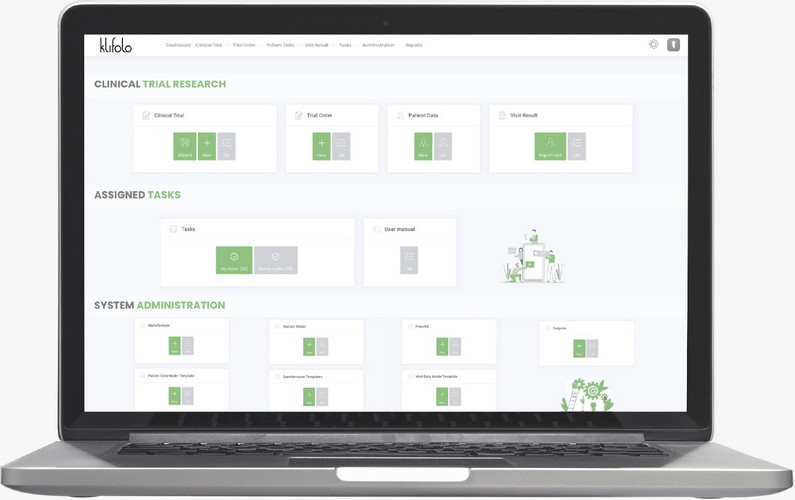
La solution Klifolo s’appuie sur le logiciel du même nom, développé spécifiquement par ASPE Conseil et Medlinks dans le but de faciliter la collecte des données cliniques PMCF, avec efficacité et maîtrise des coûts.
Le logiciel Klifolo a également la capacité d’assurer un suivi en temps réel des études cliniques post-marché en cours. Ce suivi est destiné aux fabricants et aux praticiens. L’analyse statistique des données collectées est un module intégré au logiciel qui est accessible tout au long de l’étude clinique. Par ailleurs, il existe des alertes prédéfinies par le fabricant, grâce auxquelles il peut être informé à tout moment de potentiels incidents.
L'accompagnement est assuré par une équipe expérimentée, dans l’intérêt unique de répondre aux exigences du RDM. La solution imaginée offre une souplesse particulière, qui permet aux fabricants de disposer d’une offre adaptée à leurs besoins.





 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn




















